Diagnostyka obrazowa nie jest wykorzystywana do stawiania ostatecznego rozpoznania choroby Alzheimera. Ma jednak wiele zalet. Nie tylko często pozwala określić stopień zaawansowania zmian w obrębie mózgu, ale służy głównie wykluczeniu innych przyczyn otępienia związanych ze zmianami organicznymi lub naczyniowymi [1].Wśród badań neuroobrazowych szczególnie zaznacza się rolę tomografii komputerowej ze względu na jej szeroką dostępność. Pod względem rozdzielczości metoda ta ustępuje jednak rezonansowi magnetycznemu, który uważa się za niezwykle przyszłościowe badanie w neurobrazowaniu choroby Alzheimera [1].
Zapisz się na webinar MasterClass: RADIOLOGICZNY OBRAZ CHOROBY ALZHEIMERA; dr hab. n. med. Anna Zimny

MR
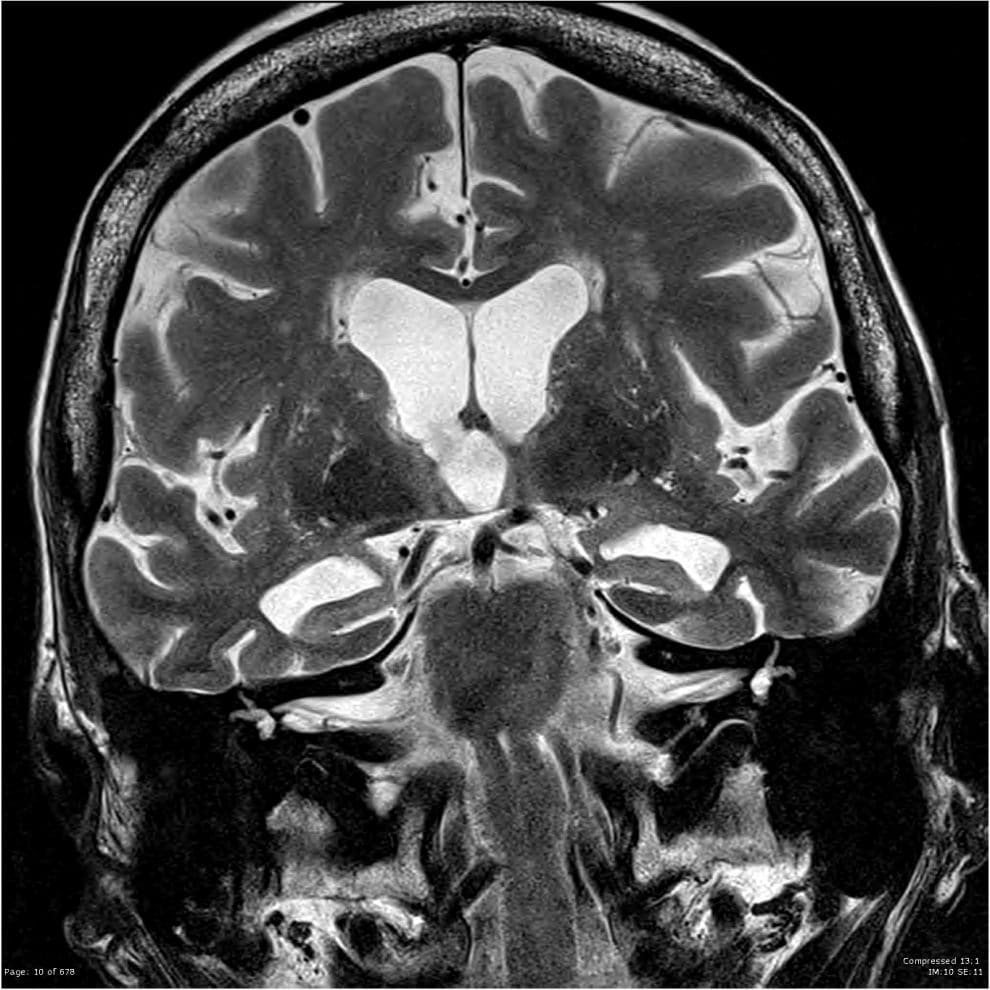
Rezonans magnetyczny jest oceniany jako najlepsze badanie w diagnostyce choroby Alzheimera [1]. Jego rola polega przede wszystkim na wykluczeniu innych przyczyn zaburzeń poznawczych oraz rozpoznaniu choroby na wczesnym etapie celem wprowadzenia innowacyjnej terapii [3]. Atrofię struktur mózgowych, która jest najbardziej wyraźnym objawem choroby Alzheimera można ocenić z wykorzystaniem wielu skal zarówno subiektywnych, jak i ilościowych – liniowych i objętościowych [1].
Stopień zaniku przyśrodkowej części płata skroniowego określa się za pomocą wizualnej skali MTA uwzględniającej szerokość szczeliny naczyniówkowej, rogu skroniowego i wysokość hipokampa na przekrojach czołowych [1,3,4]. Mimo, że ostateczny wynik jest subiektywną oceną badającego, wykazano, że czułość testu jest wysoka i koreluje z wynikiem uzyskanym w MMSE [1]. Oceny atrofii ciemieniowej dokonuje się z wykorzystaniem czterostopniowej skali Koedam. Warto wspomnieć, że zmniejszanie się objętości mózgu wraz z wiekiem jest procesem naturalnym, dotyczącym również osób niewykazujących cech otępienia [4]. U pacjentów z chorobą Alzheimera tempo tych zmian jest jednak znacznie większe, zwłaszcza w zakresie hipokampu, gdzie nawet trzykrotnie przekracza normę.
Obserwowanie w sekwencji T2-zależnej wzmożonego sygnału z istoty białej powinno budzić niepokój, ponieważ często poprzedza wystąpienie zaburzeń poznawczych. Ma to prawdopodobnie związek z przewlekłym niedokrwieniem [5].
Badanie wolumetryczne MRI pozwala określić dokładnie objętość nawet niewielkich struktur mózgowych, w tym hipokampa i kory śródwęchowej [1,4]. Te dwie charakterystyczne lokalizacje odpowiedzialne za zapamiętywanie, u pacjentów z rozpoznaną chorobą Alzheimera są znacznie mniejsze w porównaniu z populacją osób zdrowych. Atrofia płata skroniowego i zanik ciemieniowy to dwie szczególnie charakterystyczne zmiany dla otępienia o podłożu alzheimerowskim. Może im towarzyszyć kompensacyjne poszerzenie układu komorowego [1]. W wolumetrycznym badaniu MRI pokładano również duże nadzieje w przewidywaniu progresji łagodnych zaburzeń poznawczych do choroby Alzheimera. Mimo dużej swoistości, niskie wyniki w zakresie czułości badania sprawiły, że wymaga ono wsparcia ze strony innych technik obrazowych i nie może być stosowane jako wyłączna metoda diagnostyczna w tym zakresie [4]. Prawdopodobnie najbardziej precyzyjną techniką wykorzystywaną do oceny objętości poszczególnych struktur w mózgu jest automatyczne sumowanie pomiarów planimetrycznych wybranych obszarów zainteresowania (ROI). Pozwala ono z dużą dokładnością określić gęstość tkanek i przestrzeni płynowych. Wyniki tego badania cechują się jednak niską powtarzalnością i dużą zależnością od doświadczenia operatora i wprowadzonych przez niego parametrów [6]. Określenie granic ROI jest niezwykle trudne dla struktur o niewielkich wymiarach i cechujących się znaczną zmiennością anatomiczną [1].
Funkcjonalny rezonans magnetyczny (fMRI) wykorzystuje natomiast różnice we właściwościach magnetycznych poszczególnych postaci hemoglobiny i na podstawie wzajemnego stosunku oksyhemoblobiny i deoksyhemoglobiny wyznacza obszary wzmożonej aktywności mózgu [1,7,8]. U pacjentów z rozpoznaną chorobą Alzheimera i genetycznie do niej predysponowanych podczas wykonywania zadań pamięciowych zaobserwowano wzmożoną aktywność znacznie większych obszarów mózgu niż w przypadku osób zdrowych. Taki wynik może sugerować konieczność kompensacji ubytków w pamięci poprzez angażowanie innych stref [1].
Obiecującą metodą w różnicowaniu choroby Alzheimera z innymi jednostkami jest protonowa spektroskopia rezonansu magnetycznego, pozwalająca wykryć obecność wybranych metabolitów w obrębie tkanki mózgowej. Zmiany stężenia niektórych substancji są widoczne nawet we wczesnej fazie choroby Alzheimera. Obniżeniu ulega poziom N-acetyloasparaginianu, wzrasta natomiast stężenie uznawanego za marker komórek glejowych mioinozytolu w tylnym zakręcie obręczy, płatach czołowych, ciemieniowych i skroniowych, przy czym najważniejszym parametrem jest prawdopodobnie wzajemny stosunek obu tych substancji.[9]. Na podstawie obserwacji pacjentów ze stwierdzoną chorobą Alzheimera wykazano, że stężenia obu markerów ulegają dalszym zmianom wraz z progresją objawów. Stwarza to pewne szanse na wykorzystanie w przyszłości protonowej spektroskopii rezonansu magnetycznego do oceny narastania procesów neurodegeneracyjnych, a być może również monitorowania odpowiedzi na leczenie [4].
From the case rlD: 22196
PET
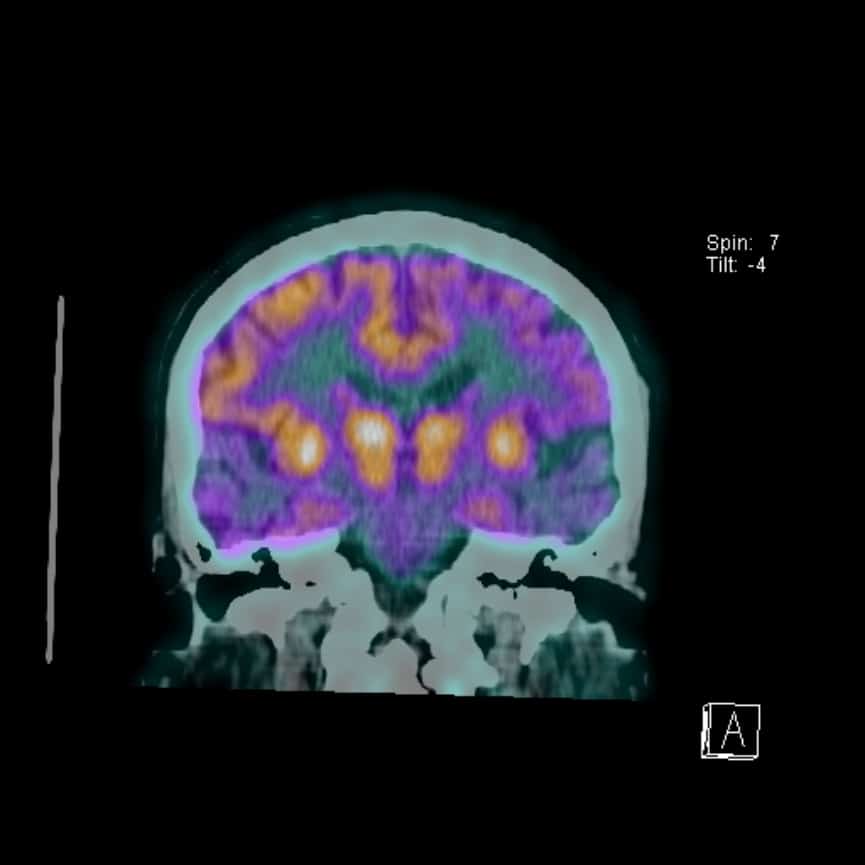
Pozytonowa tomografia emisyjna, podobnie jak inne techniki medycyny nuklearnej, wykazuje przewagę nad innymi badaniami obrazowymi ze względu na możliwości wizualizacji zmian jeszcze przed wystąpieniem jakichkolwiek objawów [10]. Z wykorzystaniem różnych znaczników izotopowych wizualizuje się obszary nagromadzenia złogów amyloidu, białka tau oraz zmniejszonego metabolizmu glukozy [5].
Wykrywaniu złogów β-amyloidu służy Pittsburgh compound B znakowany izotopem C-11 (t1/2=20 min), wiążący się selektywnie z włókienkami tego białka [1,5]. Nowszą substancją, o prawie sześciokrotnie dłuższym okresie półtrwania, wykorzystywaną w tym celu jest F-18 florbetapir. Tak długi czas połowicznego rozpadu pozwala zwiększyć kumulację radioizotopu i podnieść czułość badania [11]. Należy jednak zwrócić uwagę, że jak stwierdzono w przeprowadzanych pośmiertnie badaniach, złogi amyloidu znajdują się również w pewnej ilości w tkance mózgowej osób zdrowych, niewykazujących objawów otępienia. Ponadto, u osób z demencją liczba blaszek starczych nie koreluje ściśle ze stopniem zaawansowania deterioracji poznawczej w chorobie Alzheimera [5]. Możliwe, że taka zależność istnieje jedynie we wczesnej fazie choroby. Ujemny wynik badania PET z dużym prawdopodobieństwem umożliwia wykluczenie choroby Alzheimera jako potencjalnej przyczyny otępienia [1].
18F-flortaucipir jest znacznikiem wykorzystywanym do wykrywania białka tau w obrębie splotów neurofibrylarnych [12]. Poziom jego nagromadzenia wyraźnie wiąże się z nasileniem otępienia, jednak białko to nie jest specyficzne dla choroby Alzheimera i występuje w wielu innych chorobach, określanych mianem tauopatii. W diagnostyce wykorzystuje się niekiedy również 18-F fluorodeoksyglukozę (FDG). W badaniu PET mózgu chorego wyraźnie zaznaczają się obszary hipometabolizmu spowodowanego zmniejszonym wychwytem glukozy w rejonie skroniowo-ciemieniowym, przedklinkowym i tylnym zakręcie obręczy. Zmiany w początkowym stadium mogą być asymetryczne. W schyłkowym stadium dochodzi do zajęcia również płatów czołowych. FDG-PET wykorzystuje się w odróżnianiu choroby Alzheimera od zaniku czołowo-skroniowego, w przypadku którego obszary hipometabolizmu zlokalizowane są głównie w przednich regionach mózgu [10].
From the case rlD: 22715
SPECT
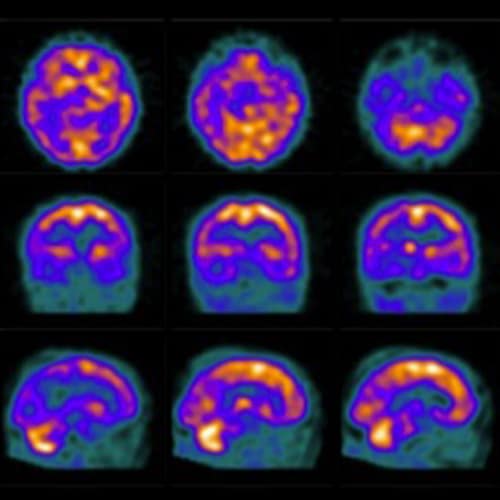
Pozytonowa tomografia emisyjna pojedynczego fotonu służy głównie ocenie mózgowego przepływu krwi i metabolizmu wybranych obszarów mózgu. W tym celu wykorzystuje się zazwyczaj radiofarmaceutyki znakowane technetem-99m. Znacznik przekracza barierę krew-mózg i gromadzi się najintensywniej w regionach o bogatym ukrwieniu, skąd emituje promieniowanie gamma [1,4]. Wynik uzyskiwany jest najczęściej w skali barwnej. Dla choroby Alzheimera i łagodnych zaburzeń poznawczych o etiologii alzheimerowskiej typowe są obszary hipometabolizmu i hipoperfuzji zlokalizowane głównie w tylnych częściach płatów skroniowych i ciemieniowych [1].
Badanie odgrywa istotną rolę w diagnostyce różnicowej poszczególnych postaci otępienia, które różnią się od siebie lokalizacją obszarów zmniejszonego przepływu mózgowego. Szczególnie dobre wyniki daje w połączeniu z testami neuropsychologicznymi [1].
From the case rID: 10896
Podsumowanie
Do tej pory żadne z badań obrazowych nie zostało uznane za idealne w diagnostyce choroby Alzheimera. Mimo wielu zalet każda z wymienionych wyżej metod niesie za sobą pewne ograniczenia. Złogi amyloidu mogą występować w tkance mózgowej zupełnie zdrowych osób w podeszłym wieku. Określenie ich ilości często nie pozwala ustalić stopnia zaawansowania choroby oraz przewidzieć jej dalszej progresji. Białko tau gromadzi się w mózgu nie tylko w przebiegu choroby Alzheimera [13]. Podobnie, obszary hipometabolizmu i hipoperfuzji są zmianami niespecyficznymi i mogą towarzyszyć wielu innym jednostkom chorobowym.
Bibliografia:
- Jerzy Walecki, Agnieszka Pawłowska-Detko, Michał Adamczyk „Rola współczesnych metod obrazowania w rozpoznaniu i monitorowaniu otępienia” Pol. Przegl. Neurol 2007;3(2):69-89.
- Reynolds A. Alzheimer disease: focus on computed tomography. Radiol Technol. 2013 Nov-Dec;85(2):187CT-211CT. PMID: 24255154.
- Frederik Barkhof, Marieke Hazewinkel, Maja Binnewijzend and Robin Smithuis: Dementia – Role of MRI; RadiologyAssistant
- Sylwia Ferenc, Natalia Ciesielska, Remigiusz Sokołowski, Karolina Klimkiewicz, Marta Podhorecka, Kornelia Kędziora-Kornatowska „Badania neuroobrazowe w diagnostyce łagodnych zaburzeń neuropoznawczych o etiologii alzheimerowskiej” Gerontologia Polska 2016, 24, 142-150
- J.D. Oldan, V.L. Jewells, B. Pieper, T.Z. Wong. Complete Evaluation of Dementia: PET and MRI Correlation and Diagnosis for the Neuroradiologist. (2021) American Journal of Neuroradiology. 42 (6): 998. doi:10.3174/ajnr.A7079 – Pubmed
- Ahmed S, Kim BC, Lee KH, Jung HY; Alzheimer’s Disease Neuroimaging Initiative. Ensemble of ROI-based convolutional neural network classifiers for staging the Alzheimer disease spectrum from magnetic resonance imaging. PLoS One. 2020 Dec 8;15(12):e0242712. doi: 10.1371/journal.pone.0242712. PMID: 33290403; PMCID: PMC7723284.
- Colangeli S, Boccia M, Verde P, Guariglia P, Bianchini F, Piccardi L. Cognitive Reserve in Healthy Aging and Alzheimer’s Disease: A Meta-Analysis of fMRI Studies. Am J Alzheimers Dis Other Demen. 2016 Aug;31(5):443-9. doi: 10.1177/1533317516653826. Epub 2016 Jun 14. PMID: 27307143.
- Chandra A, Dervenoulas G, Politis M; Alzheimer’s Disease Neuroimaging Initiative. Magnetic resonance imaging in Alzheimer’s disease and mild cognitive impairment. J Neurol. 2019 Jun;266(6):1293-1302. doi: 10.1007/s00415-018-9016-3. Epub 2018 Aug 17. PMID: 30120563; PMCID: PMC6517561.
- Zhu X, Schuff N, Kornak J, Soher B, Yaffe K, Kramer JH, Ezekiel F, Miller BL, Jagust WJ, Weiner MW. Effects of Alzheimer disease on fronto-parietal brain N-acetyl aspartate and myo-inositol using magnetic resonance spectroscopic imaging. Alzheimer Dis Assoc Disord. 2006;20:77.
- Rice L, Bisdas S. The diagnostic value of FDG and amyloid PET in Alzheimer’s disease-A systematic review. Eur J Radiol. 2017 Sep;94:16-24. doi: 10.1016/j.ejrad.2017.07.014. Epub 2017 Jul 20. PMID: 28941755.
- Wong DF, Rosenberg PB, Zhou Y, Kumar A, Raymont V, Ravert HT, Dannals RF, Nandi A, Brasić JR, Ye W, Hilton J, Lyketsos C, Kung HF, Joshi AD, Skovronsky DM, Pontecorvo MJ. In Vivo Imaging of Amyloid Deposition in Alzheimer’s Disease using the Novel Radioligand 18FAV-45 (Florbetapir F 18). „J Nucl Med”. 51 (6), s. 913–20, 2010 Jun.
- Kunal P. Patel, David T. Wymer, Vinay K. Bhatia, Ranjan Duara, Chetan D. Rajadhyaksha. Multimodality Imaging of Dementia: Clinical Importance and Role of Integrated Anatomic and Molecular Imaging. (2020) RadioGraphics. 40 (1): 200-222. doi:10.1148/rg.2020190070 – Pubmed
- Kovacs GG. Tauopathies. Handb Clin Neurol. 2017;145:355-368. doi: 10.1016/B978-0-12-802395-2.00025-0. PMID: 28987182.
 E-booki
E-booki Sklep „Resonaria”
Sklep „Resonaria” Webinary radiologiczne
Webinary radiologiczne Webinary neurologiczne
Webinary neurologiczne Aktualności
Aktualności Dodaj artykuł
Dodaj artykuł



